Our Blog
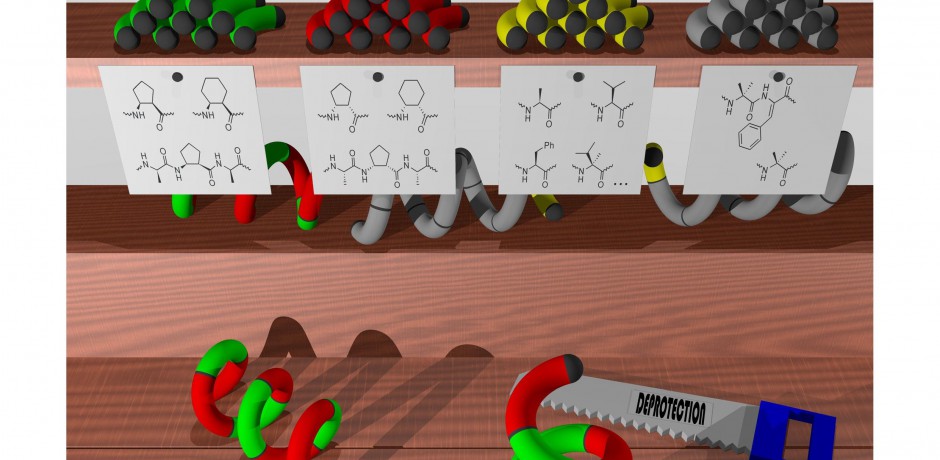
In den letzten Jahren hat sich der Einsatz der Mikrowelle bei der Synthese von Peptiden mehr und mehr durchsetzen können. Zahlreiche Publikationen belegen, dass unter Mikrowelleneinwirkung gerade sehr schwierige Sequenzen gut synthetisierbar werden, was vor allem auf die Eliminierung der Aggregationsproblematik hydrophober Peptidketten zurückzuführen ist. Hervorzuheben ist, dass es im Mikrowellenfeld trotz thermischer Effekte zu einer Unterdrückung der Racemisierung kommt. In Verbindung mit einer geeigneten Capping / Tagging-Strategie lassen sich heutzutage auch Peptide mit mehr als 100 Aminosäuren an einem Stück synthetisieren.
Apparativ stehen dem Anwender dabei mittlerweile sowohl manuelle als auch vollautomatisierte Systeme zur Verfügung. Mit steigender Peptidlänge macht die Anwendung eines automatisierten Systems Sinn – nicht zuletzt aufgrund der höheren Zuverlässigkeit. Hierfür stehen mit der Liberty-Familie verschiedene vollautomatisierte Systeme zur Verfügung, die in den letzten Jahren software- und hardwaretechnisch soweit optimiert wurde, dass mittlerweile praktisch jede Art von Chemie auf einfache Art und Weise implementiert werden kann.
Dr. Monika Szefczyk, ist Forscherin im Labor von Prof. Dr. Lukasz Berlicki am Institut für Bioorganische Chemie der Wrocław University of Science and Technology. Sie traf sich mit CEM, um ihre Forschung zu Peptidfoldameren vorzustellen, die in der SARS-Cov-2-Hemmung angewendet werden. Prof. Dr. Berlickis Labor besitzt einen CEM Liberty Blue Mikrowellen-Peptidsynthesizer.
Frage: Können Sie Hintergrundinformationen zur Berlicki-Forschungsgruppe liefern?
Dr. Szefczyk: Das Berlicki Lab ist eine der fünf Forschungsgruppen des Instituts für Bioorganische Chemie der Wrocław University of Science and Technology. Es wird von Professor Łukasz Berlicki geleitet und besteht aus sieben Forschern/innen und drei Doktoranden/innen. Unsere Forschung konzentriert sich auf drei Hauptthemen:
1) Struktur, biologische und katalytische Aktivität von Peptidfoldameren,
2) Synthese und Aktivität von Inhibitoren ausgewählter Enzyme und
3) Peptid-basierte Nanostrukturen.
Wir leiten 5 laufende Forschungsprojekte, die vom Nationalen Wissenschaftszentrum und der Polnischen Nationalen Agentur für akademischen Austausch mit einem Gesamtbetrag von mehr als 5 Mio. EURO finanziert werden.
Frage: Was sind Ihre wichtigsten Forschungsziele?
Dr. Szefczyk: Wir arbeiten hauptsächlich an Peptidfoldameren – Oligomeren, die eine hohe Tendenz zur Faltung in stabile dreidimensionale Strukturen in Lösung aufweisen. Die Möglichkeit der rationalen Konstruktion strukturell ausgedehnter Moleküle bietet die Möglichkeit, Materialien mit zahlreichen Funktionalitäten herzustellen. Die Entwicklung einer rationalen Strategie zur Erzielung erweiterter proteinartiger foldamerer Strukturen (sogenannte foldamerische Miniproteine) ist eines unserer Hauptziele. Anschließend wenden wir die erhaltenen Strukturen zum Aufbau von Molekülen an, die katalytische oder biologische Aktivitäten aufweisen. Der Aufbau von Enzymmimetika liefert Katalysatoren für verschiedene Reaktionen und ermöglicht ein besseres Verständnis der Wirkung nativer Enzyme. Darüber hinaus synthetisieren wir Protein-Protein-Interaktionsinhibitoren, die möglicherweise in der Krebsimmuntherapie nützlich sind. Kürzlich haben wir uns auf die Gruppe der Peptidfoldamere konzentriert, die die Interaktion von menschlichem ACE2- und SARS-Cov-2-Virus-S-Protein hemmen können. Solche Verbindungen könnten den Viruseintritt in menschliche Zellen stoppen und Kandidaten für Arzneimittel gegen Covid-19 sein. Wir konzentrieren uns auch auf einen weiteren interessanten Aspekt von Peptidfoldameren, nämlich ihre Fähigkeit, durch kontrollierte Selbstaggregation Nanostrukturen zu bilden. Wir haben verschiedene Peptide mit Beta-Aminosäuren entworfen, synthetisiert, charakterisiert und daraus Nanofibrillen im Prozess der Selbstassoziation erhalten. Jetzt bemühen wir uns, verschiedene mikroskopische Techniken zu entwickeln, die der Charakterisierung erhaltener Nanostrukturen und Bionanomaterialien im Allgemeinen gewidmet sind.
Frage: Wie hat die Peptidsynthese im Liberty Blue Ihre Forschung verbessert?
Dr. Szefczyk: Am wichtigsten ist es, dass wir mit dem Liberty Blue die Synthesezeit erheblich verkürzen und die Kosten für Lösungsmittel und Abfall im Vergleich zu anderen automatisierten Synthesizern senken konnten. In unserem Fall ist der Unterschied signifikant, wenn man eine große Anzahl von Peptiden mit langen Sequenzen berücksichtigt, die wir in unserem Labor synthetisieren. Darüber hinaus konnten wir die Synthese von Peptiden mit sogenannten „schwierigen Sequenzen“ leicht optimieren.
Frage: Glauben Sie, dass das Liberty Blue für andere Wissenschaftler nützlich sein könnte?
Dr. Szefczyk: Wir würden den Liberty Blue als einfach zu verwendenden, zeit- und kostensparenden Synthesizer empfehlen, der es uns ermöglicht, Peptide mit guter Ausbeute und Reinheit zu erhalten. Erwähnenswert ist auch die Verfügbarkeit professioneller Unterstützung durch die technischen Spezialisten von CEM.
Frage: Wo sollten Chemiker nach weiteren Informationen zu Ihrer Forschung suchen?
Dr. Szefczyk: Wir sind auf Facebook und Twitter @berlickilab. Weitere Informationen finden Sie auch auf der Webseite unserer Abteilung: http://bioorganic.ch.pwr.wroc.pl/ oder in den ausgewählten Veröffentlichungen unten.
- Fortuna, P.; Linhares, B. M.; Purohit, T.; Pollock, J.; Cierpicki, T.; Grembecka, J.; Berlicki, Ł., Covalent and noncovalent constraints yield a figure eight-like conformation of a peptide inhibiting the menin-MLL interaction J. Med. Chem. 2020, 207, 112748.
- Drewniak, M.*; Węglarz-Tomczak, E*; Ożga, K.; Rudzińska-Szostak, E.; Macegoniuk, K.; Tomczak, J. M.; Bejger, M.; Rypniewski, W.; Berlicki, Ł. *contributed equally., Helix-loop-helix peptide foldamers and their use in the construction of hydrolase mimetics. Chem. 2018, 81, 356.
- Szefczyk, M.; Węglarz-Tomczak, E.; Fortuna, P.; Krzysztoń, A.; Rudzińska-Szostak, E.; Berlicki, Ł., Controlling the Helix Handedness of ααβ-Peptide Foldamers through Sequence Shifting Angew. Int. Ed. 2017, 56, 2087.
- Rudzińska-Szostak, E.; Berlicki, Ł., Sequence engineering to control the helix handedness of peptide foldamers Eur. J. 2017, 23, 14980.
- Magiera-Mularz, K.; Skalniak, L.; Zak, K. M.; Musielak, B.; Rudzinska-Szostak, E.; Berlicki, Ł.; Kocik, J.; Grudnik, P.; Sala, D. Zarganes-Tzitzikas, T.; Shaabani, S.; Dömling, A.; Dubin, G.; Holak, T. A., Bioactive Macrocyclic Inhibitors of the PD-1/PD-L1 Immune Checkpoint Chem. Int. Ed. 2017, 56, 13732.